禾博医药:凝聚中医临床研究力量
1、中医学界对临床研究的长期忽视
近代以来,先后出现了中西医汇通、中医科学化、中西医结合、中医现代化等思潮。受上述思潮的影响,中医药研究多为机制研究,迫切希望“现代化”。究其原因,多是认为每一种中医疗法都是有效的,没必要验证疗效;或是现代医学快速发展,极大推动了西医的发展,中医药也急需与现代科学接轨;或是借用了现代西药研发的模式,从基础研究走向临床研究[1]。
事实上,中医药经受了上千年的实践检验,其基本疗效是值得信赖的,但并不说明每种中医疗法都疗效确切;中医药研究者希望找到中医药治疗的机制或物质基础,但必须建立在疗效确证的基础上;西药在首次进入人体前疗效和安全性是未知的,因此需要临床前研究,而中医药目前已在临床广泛应用 [1]。以肿瘤研究为例,当前,高质量的临床研究在开展前需要进行注册。中国临床试验注册中心(http://www.chictr.org.cn/index.aspx)的数据显示中医肿瘤学临床研究数量显著低于西医研究,且增长缓慢(见图1)。这反映出中医肿瘤学界对临床研究重要性的严重忽视。因此必须充分重视疗效为先导的临床研究。[2]
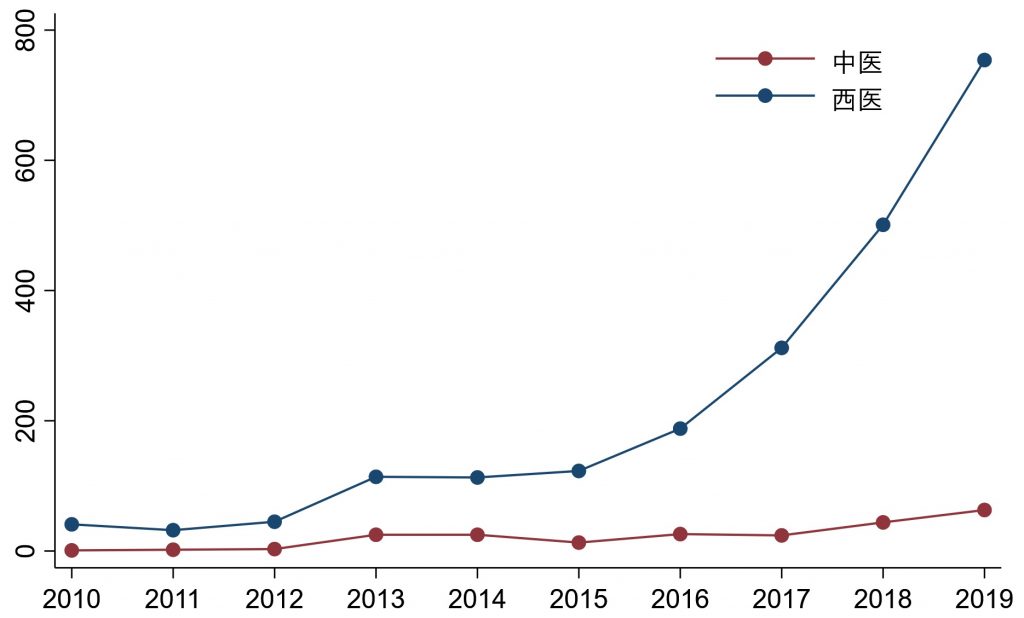
图1 肿瘤学临床研究数量。(数据统计自中国临床试验注册中心)
2、严格的临床研究规范提高了中医研究的门槛
中医学界普遍缺乏临床研究所需的基本素养。由于缺乏良好的临床研究方法学的训练,中医临床研究的规范性普遍较差。这体现在研究的设计、实施、分析、应用等各个阶段。研究设计缺乏可行性,研究实施阶段则难以开展,不可能获得高质量的数据;研究实施阶段缺乏规范性,则难以获得真实、可靠的高质量数据,分析阶段则无以为继,不可能形成高质量证据;研究分析没能形成高质量证据,研究结果则难以推广,中医的学术发展则止步不前。因此,中医临床研究必须与国际最新技术和规范接轨,才能为中医发展提供临床疗效证据。
当今时代,临床研究临床研究的各个阶段(从准备到研究结束)都离不开计算机化系统的辅助,而确保数据质量及其真实完整性是使用 EDC 系统的根本要求。因此,部署 EDC 需要考虑数据质量与真实完整性、系统的风险管理、系统的生命周期等,对包括功能性软件、配套的硬件设施、研发和使用人员的资历和培训、设备运行管理(如标准操作程序、 维护等)及系统应用环境(如变更管理和安全保障、后台数据存储要求和管理、不同系统间的数据交换管理及其程序)等都提出了很高要求。[3]这对研究团队自行部署 REDCap 带来很大困难。
3、禾博医药:用技术凝聚中医临床研究力量
禾博医药致力于为纵向课题来源的临床研究项目提供权威、公认的临床试验数据采集系统(EDC),包括数据采集、数据存储、数据处理、随访支持服务。系统部署于阿里云安全型服务器和数据库,高效实现 EDC 的功能,同时保证系统在数据的安全性。

禾博医药EDC 系统依托研究数据电子化采集系统 REDCap (Research Electronic Data Capture)及访优(FollowU)随访小程序建立,实现从数据采集、数据存储、随访支持、数据处理、统计分析与科研作图一体化管理,助力医学研究。
该系统安装在安全的物理环境中,阿里云通过如下措施保障保障物理环境的安全性: 对载体接触人员的限制、记录和监控;双电源或 UPS;防震、防火、防水、防热、防潮(非主观的);防破坏、防盗窃(主观的)等。此外,通过建立防火墙或其他软硬件等以防病毒、木马、黑客、间谍软件入侵等措施保障系统的网络环境,即数据传输的电子网络(如互联网或局域网)所处的环境。禾博医药的 EDC 系统符合电子通用技术文档规范( Electronic Common TechnicalDocument,eCTD)、信息系统验证指南( Good Automated Manufacturing Practice,GAMP) 、医疗电子信息交换标准( Health Level 7,HL7) 、 临床试验数据交换标准( Clinical Data Interchange Standard Consortium,CDISC )、临床试验数据管理操作流程指南( Good Clinical Data Management Practice)等文件的规范,具有实时、可信、安全、灵活的特点。[4-6]
范德堡大学保罗教授为全世界提供了临床数据采集工具,建立了庞大的REDCap联盟。前人的奉献和伟业振奋人心。禾博医药研究院团队希望以禾博医药EDC 系统为平台,凝聚中医临床研究的力量,为中医的科学话语权奋斗!
参考文献:
[1] Tang J L. Research priorities in traditional Chinese medicine[J]. BMJ, 2006, 333(7564): 391-4.
[2]甄宏德,桑贞琦,章敏,刘考铧,张爱琴.中医肿瘤学临床研究中的动态辨证模式[J].中华中医药杂志,2021,36(02):654-658.
[3]国家食品药品监管总局. 总局关于发布临床试验数据管理工作技术指南的通告[OL]. . https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20160729183801891.html.
[4] Food and Drug Administration. Electronic Common Technical Document (eCTD)[OL]. [2021-06-22]. https://www.fda.gov/drugs/electronic-regulatory-submission-and- review/electronic-common-technical-document-ectd.
[5] ISPE | International Society for Pharmaceutical Engineering. What is GAMP®?[OL].
[2021-06-22]. https://ispe.org/initiatives/regulatory/what-gamp.
[6] Society for Clinical Data Management. GCDMP© – Society for Clinical Data Management (SCDM)[OL]. [2021-06-22]. https://scdm.org/gcdmp/.

